جهت پیشرفت واکنش ΔG و ΔS
ارسال شده: پنجشنبه ۲۶ فروردین ۱۳۸۹, ۵:۰۱ ب.ظ
به نام خداوند بخشاینده مهربان
در واکنش ها و استحاله ها:
1-واکنش برگشت پذیر است.
2-واکنش برگشت پذیر نیست.
3-واکنش غیر قابل انجام است.
[HR]
ΔS یا آنتروپی:
معیاری در برگشت پذیری واکنش هاست به این ترتیب که:
اگر ΔS=0 بود , سیستم ما در حال تعادل است
اگر ΔS منفی بود , واکنش در جهت عکس پیشروی میکند
اگر ΔS مثبت بود واکنش به اصطلاح خود به خودی است و به صورت عادی آنجام میشود.
تغییرات آنتروپی ΔS در یک سیستم نمایانگر میزان پیشرفت در یک واکنش شیمیایی میباشد , شکل پایین به روشنی جایی که آنتروپی
بیشترین مقدار را دارد نشان میدهد.
[External Link Removed for Guests]
در طبیعت به دلیل خود به خود بودن تمامی تحولات , با افزایش آنتروپی در کل جهان روبرو هستیم.
فرمول محاسبه آنتروپی:
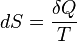 و
و 
*
(ds=q/T که گرما=q و دما=T)
[HR]
ΔG یا انرژی آزاد:
تحلیلی از ΔG :
اگر ΔG صفر باشد , تحول در حال تعادل است.
اگرΔG منفی باشد , واکنش به صورت خود به خود پیشرفت می کند.
اگر ΔG مثبت باشد , آنگاه تحول غیر ممکن خواهد بود.
فرمول و نحوه محاسبه انرژی آزاد یا ΔG:


ΔG = a +BT (ln)T + CT
[HR]
تصاویر از: whatislife.com و en.wikipedia.org
منبع: centralclubs.com
در واکنش ها و استحاله ها:
1-واکنش برگشت پذیر است.
2-واکنش برگشت پذیر نیست.
3-واکنش غیر قابل انجام است.
[HR]
ΔS یا آنتروپی:
معیاری در برگشت پذیری واکنش هاست به این ترتیب که:
اگر ΔS=0 بود , سیستم ما در حال تعادل است
اگر ΔS منفی بود , واکنش در جهت عکس پیشروی میکند
اگر ΔS مثبت بود واکنش به اصطلاح خود به خودی است و به صورت عادی آنجام میشود.
تغییرات آنتروپی ΔS در یک سیستم نمایانگر میزان پیشرفت در یک واکنش شیمیایی میباشد , شکل پایین به روشنی جایی که آنتروپی
بیشترین مقدار را دارد نشان میدهد.
[External Link Removed for Guests]
در طبیعت به دلیل خود به خود بودن تمامی تحولات , با افزایش آنتروپی در کل جهان روبرو هستیم.
فرمول محاسبه آنتروپی:
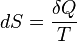 و
و 
*
(ds=q/T که گرما=q و دما=T)
[HR]
ΔG یا انرژی آزاد:
تحلیلی از ΔG :
اگر ΔG صفر باشد , تحول در حال تعادل است.
اگرΔG منفی باشد , واکنش به صورت خود به خود پیشرفت می کند.
اگر ΔG مثبت باشد , آنگاه تحول غیر ممکن خواهد بود.
فرمول و نحوه محاسبه انرژی آزاد یا ΔG:


ΔG = a +BT (ln)T + CT
[HR]
تصاویر از: whatislife.com و en.wikipedia.org
منبع: centralclubs.com